CDE发布的《先进治疗药品的范围、归类和释义(征求意见稿)》![]() 《先进治疗药品的范围、归类和释义(征求意见稿)》 (1).pdf,首次将细胞外囊泡(含外泌体)明确纳入“先进治疗药品”监管范畴。这一规定彻底扭转了外泌体产品长期游走于化妆品、医疗器械监管灰色地带的局面。
《先进治疗药品的范围、归类和释义(征求意见稿)》 (1).pdf,首次将细胞外囊泡(含外泌体)明确纳入“先进治疗药品”监管范畴。这一规定彻底扭转了外泌体产品长期游走于化妆品、医疗器械监管灰色地带的局面。
COP西林瓶
CDE征求意见稿首次在国家级监管文件中清晰界定:细胞外囊泡(含外泌体)作为细胞分泌的功能性活性物质,当其具有明确治疗功能时,将纳入先进治疗药品监管体系。文件将外泌体置于“细胞衍生物药品”以及“新型递送系统”亚类,与“干细胞治疗药品”、“基因编辑药品”并列,彻底剥离了其长期依附的“化妆品”或“医美材料”概念,将其正式推向严肃的治疗药物赛道。这一界定意味着,具有治疗目的的外泌体产品,其监管属性发生了根本性跃迁——从可能相对宽松的器械、化妆品或未明确监管的范畴,直接跃升纳入与创新药同等级别的监管框架。外泌体被纳入ATMP监管体系,如同在高速发展的产业赛道中央筑起了一道符合国际标准的药品级高墙。包装系统合规性面临全新考验。根据《药品管理法》第五十二条,直接接触药品的包装材料和容器必须符合药用要求,符合保障人体健康、安全的标准。对不合格的直接接触药品的包装材料和容器,药品监督管理部门将责令停止使用。外泌体产品合规必须满足三大要素:需具备“活性成分+治疗功能”;经复杂提纯/修饰/包装;明确治疗适应证。包装系统必须确保在整个药品有效期内保持稳定性、密封性和保护性,防止外泌体活性成分降解或变质。
外泌体产品开发必须遵循GLP(非临床研究质量管理规范)、GCP(药物临床试验质量管理规范),最终在GMP条件下生产。规模化生产与质控成为生死线。企业必须解决外泌体的大规模、高纯度、高均一性、高稳定性的生产难题,建立严格的质量标准并进行放行检验。药品级监管要求包装系统必须进行全面的相容性研究,确保包装材料与外泌体制剂之间不会发生相互作用,导致安全性或有效性问题。外泌体产品的包装必须进行严格的容器密封完整性测试,确保在运输、储存和使用过程中维持无菌状态,防止微生物侵入。环烯烃聚合物COP西林瓶凭借其优异的透明度、低蛋白吸附、耐极端温度等特性,正成为高附加值药物的包装首选。在超低温环境下,包装系统的密封完整性直接决定药品安全与有效性。传统玻璃瓶因与胶塞收缩率差异大,易发生微泄漏,而COP材料与胶塞在-196℃液氮下的收缩差异可控制在0.5μm以内,显著降低了泄漏风险。COP材料具有高化学惰性和纯度,其表面能低,表现出极低的蛋白吸附特性,能够最大限度地减少外泌体的吸附损失,确保给药剂量的准确性。
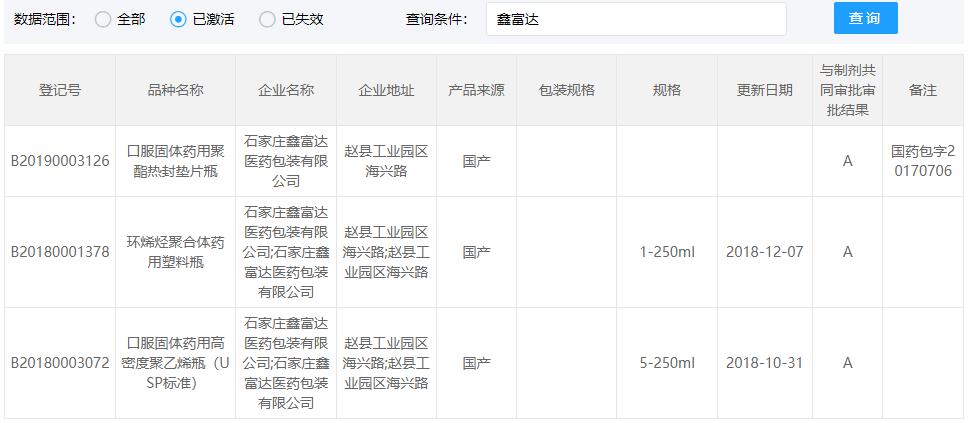
COP西林瓶CDE登记号为A状态
随着CDE新规的落地,外泌体产业将迎来全链条的监管升级。包装系统的选择已不再是简单的成本考量,而是关系到药品能否通过审评审批的关键因素。药品级监管虽然短期内会增加企业的合规成本,但长远看将推动外泌体产业走向高质量、标准化发展。
 咨询热线:400-888-1942
咨询热线:400-888-1942