药典2020版99101 分析方法验证指导原则
分析方法验证(analtical method validation)的目的是证明建立的方法适合于相应检测要求。在建立药品质量标准、变更药品生产工艺或制剂组分、修订原分析方法时,需对分析方法进行验证,生物制品质量控制中采用的方法包括理化分析方法和生物学测定方法,其中理化分析方法的验证原则与化学药品基本相同,所以可参照本指导原则进行,但在进行具体验证时还需要结合生物制品的特点考虑;相对于理化分析方法而言,生物学测定方法存在更多的影响因素,因此本指导原则不涉及生物学测定方法验证的内容。
验证的分析项目有:鉴别试验、杂质测定(限度或定量分析)、含量测定(包括特性参数和含量/效价测定,其中特性参数如:药物洛出虚、释放度等).
验证的指标有:专属性、准确度、精密度(包括重复性、中间精密度和重现性)、检测限、定量限、线性、范围和耐用性。在分析方法验证中,须用标准物质进行试验,由于分析方法具有各自的特点,并随分析对象而变化,因此需要视具体情况拟订验证的指标,表1中列出的分析项目和相应的验证指标可供参考。
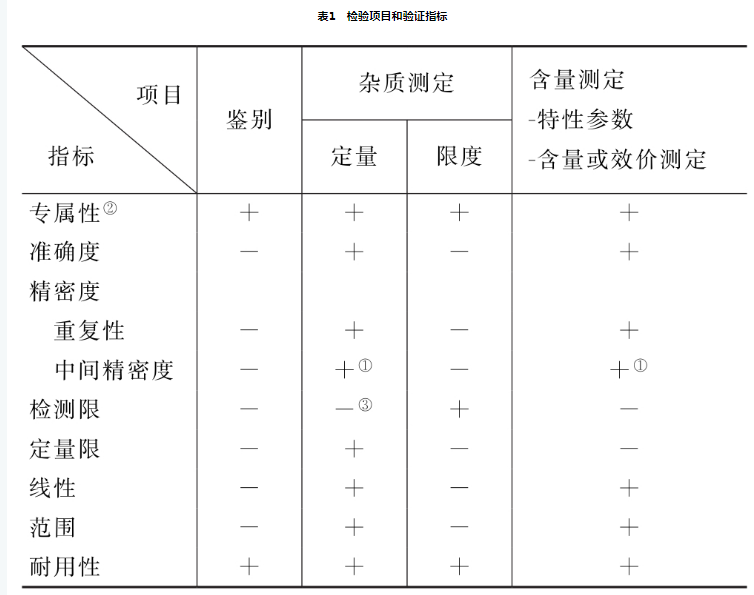
①已有重现性验证,不需验证中间精密度。
②如一种方法不够专属,可用其他分析方法予以补充。
③视具体情况予以验证。
方法验证内容如下
一、专属性
专属性系指在其他成分(如杂质、降解产物、辅料等)可能存在下,采用的分析方法能正确测定出被测物的能力。鉴别反应、杂质检査和含量测定方法,均应考察其专属性。如方法专属性不强,应采用一种或多种不同原理的方法予以补充。
1.鉴别反应
应能区分可能共存的物质或结构相似的化合物,不含被测成分的供试品,以及结构相似或组分中的有关化合物,应均呈阴性反应
2.含量测定和杂质测定
采用的色谱法和其他分离方法,应附代表性图谱,以说明方法的专属性,并应标明诸成分在图中的位置,色谱法中的分离度应符合要求。
在杂质对照品可获得的情况下,对于含量测定,试样中可加入杂质或辅料,考家测定结果是否受干扰,并可与未加杂质或辅料的试样比较测定结果对于杂质检查,也可向试样中加入一定量的杂质,考察杂质之间能否得到分离。
在杂质或降解产物不能获得的情况下,可将含有杂质或降解产物的试样进行测定,与另一个经验证的方法或药典方法比较结果。也可用强光照射、高温、高温、酸(碱)水解或氧化的方法进行强制破坏,以研究可能的降解产物和降解途径对含量测定和杂质测定的影响。含量测定方法应比对两种方法的结果,杂质检査应比对检出的杂质个数,必要时可采用光电二极管阵列检测和质谱检测,进行峰纯度检查。
二、准确度
准确度系指用所建立方法测定的结果与真实值或参比值接近的程度,一般用回收率(%)表示,准确度应在规定的线性范围内试验。准确度也可由所测走的精密度,线性和专居性推算出来。
在规定范围内,取同一浓度(相当于100%浓度水平)的供试品,用至少6份样品的测定结果进行评价;或设计至少3种不同浓度,每种浓度分别制备至少3份供试品溶液进行测定,用至少9份样品的测定结果进行评价,且浓度的设定应考虑样品的浓度范围。两种方法的选定应考虑分析的目的和样品的浓度范围。
1.化学药含量测定方法的准确度
原料药可用已知纯度的对照品或供试品进行测定,或用所测定结果与已知准确度的另一个方法测定的结果进行比较。制剂可在处方量空白辅料中,加入已知量被测物对照品进行测定,如不能得到制剂辅料的全部组分,可向待测制剂中加入已知是的被测物进行测定,或用所建立方法的测定结果与己知准确度的另一个方法测定结果进行比较。
2.化学药杂质定星测定的准确度
可向原料药或制剂中加入已知量杂质对照品进行测定,如不能得到杂质对照品,可用所建立的方法与另一成熟方法(如药典标准方法或经过验证的方法)的测定结果进行比较。
3.中药化学成分测定方法的准确度
可用已知纯度的对照品进行加样回收率测定,即向已知被测成分含量的供试品中再精密加入一定量的已知纯度的被测成分对照品,依法测定。用实测值与供试品中含有量之差,除以加入对照品量计算回收率。在加样回收试验中须注意对照品的加入量与供试品中被测成分含有量之和必须在标准曲线线性范用之内;加入的对照品的是要适当,过小则引起较大的相对误差,过大则干扰成分相对减少,真实性差。
4.数据要求
对于化学药应报告已知加入量的回收率(%),或测定结果平均值与真实值之差及其相对标准偏差或置信区间(置信度一般为95%);对于中药应报告供试品取样量、供试品中含有量、对照品加入量、测定结果和回收率(%)计算值,以及回收率(%)的相对标准信差(RSD%)或置信区间。样品中待测定成分含量和回收率限度关系可参考表2。在基质复杂、组分含量低于0.01%及多成分等分析中,回收率限度可适当放竞。
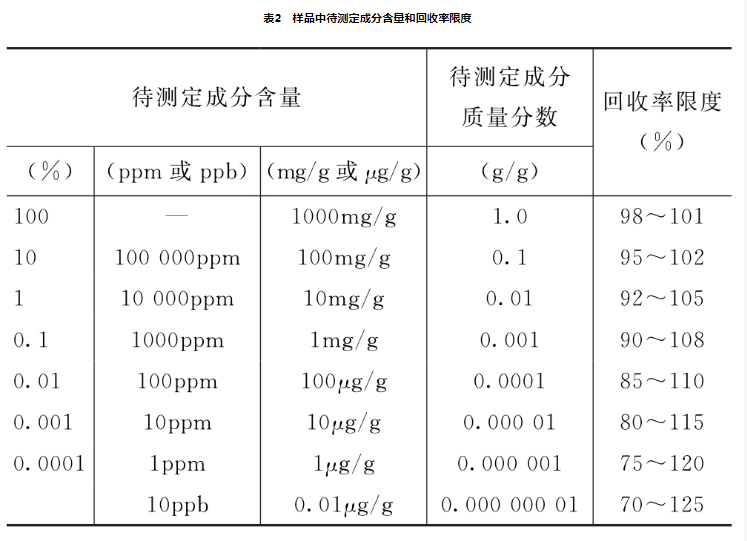
比表AOAc, 《Guidelines for Single Laboratory Validation of chemical Methods for Dietary supplements and Botanicals)
三、精密度
精密度系指在规定的测定条件下,同一份均匀供试品,经多次取样测定所得结果之间的接近程度。精密度一般用偏差、标准偏差或相对标准偏差表示。
在相同条件下,由同一个分析人员测定所得结果的精密度称为重复性;在同一实验室内的条件改变,如不同时间、不同分析人员、不同设备等测定结果之间的精密度,称为中间精密度;不同实验室测定结果之间的精密度,称为重现性。
含量测定和杂质的走量测走应考察方法的精密度。
1.重复性
在规定范围内,取同一浓度(分析方法拟定的样品测定浓度,相当于100%浓度水平)的供试品,用至少6份的测定结果进行评价;或设计至少3种不同浓度,每种浓度分别制备至少3份供试品涪液进行测定,用至少9份样品的测定结果进行评价。采用至少9份测定结果进行评价时,浓度的设定应考虑样品的浓度范围。
2.中间精密度
考察随机变动因素,如不同日期、不同分析人员、不同仪器对精密度的影响,应进行中间精密度试验
3.重现性
国家药品质量标准采用的分析方法,应进行重现性试验,如通过不同实验室协同检验获得重现性结果。协同检验的目的、过程和重现性结果均应记载在起草说明中,应注意重现性试验所用样品质量的一致性及贮存运输中的环境对该一致性的影响,以免影响重现性试验结果,
4.数据要求
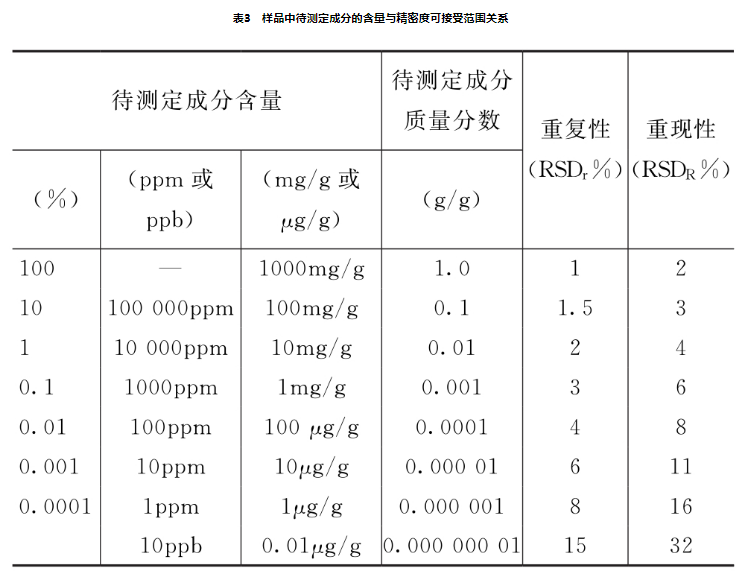
均应报告标准偏差、相对标准偏差或置信区间,样品中待测定成分含量和精密度RSD可接受范围参考表3(可接受范用可在给出数值0.5~2倍区间,计算公式,重复性:RSD-C-015;重现性:RSDg=2c-015,其中C为待测定成分含量)。在基质复杂、组分含虽低于0.01%及多成分等分析中,精密度限度可适当放竞。
四、检测限
检测限系指试样中被测物能被检测出的最低量。检测限仅作为限度试验指标和定性鉴别的依据,没有定量意义。常用的方法如下
1.直观法
用已知浓度的被测物,试验出能被可靠地检测出的最低浓度或量
2.信噪比法
用于能显示基线噪声的分析方法,即把已知低浓虚试样测出的信号与空白样品测出的信号进行比较,计算出能被可靠地检测出的被测物质最低浓度或量,一般以信噪比为3:1时相应浓度或注入仪器的量确定检测限。
3.基于响应值标准偏差和标准曲线斜率法
按照LOD=3.38/S公式计算。式中LOD:检测限;8:响应值的偏差;5:标准曲线的斜率。8可以通过下列方法测得:①测定空白值的标准偏差;@标准曲线的剩余标准信差或是截距的标准偏差
4.数据要求
上述计算方法获得的检测限数据须用含量相近的样品进行验证,应附测定图谱,说明试验过程和检测限结果
五、定量限
定量限系指试样中被测物能被定量测定的最低量,其测定结果应符合准确度和精密度要求。对微量或痕量药物分析、定星测定药物杂质和降解产物时,应确走方法的走量限,常用的方法如下,
1.直观法
用已知浓度的被测物,试验出能被可靠地定量测定的最低浓度或量
2.信噪比法
用于能显示基线噪声的分析方法,即将已知低浓度试样测出的信号与空白样品测出的信号进行比较,计算出能被可靠地定量的被测物质的最低浓度或量,一般以信噪比为10:1时相应浓度或注入仪器的是确定走量限,
3.基于响应值标准偏差和标准曲线斜率法
4.数据要求
上述计算方法获得的定量限数据须用含量相近的样品进行验证,应附测试图谱,说明测试过程和定是限结果,包括准确度和精密度验证数据,
六、线性
线性系指在设计的范围内,线性试验结果与试样中被测物浓度直接星比例关系的能力。
应在设计的范围内测定线性关系。可用同一对照品贮备液经精密样释,或分别精密称取对照品,制备一系列对照品溶液的方法进行测定,至少制备5个不同浓虚水平。以测得的响应信号作为被测物浓虚的函数作图,观家是否呈线性,再用最小二乘法进行线性回归。必要时,响应信号可经数学转换再进行线性回归计算,或者可采用描述浓度-响应关系的非线性模型。
数据要求:应列出回归方程、相关系数、残差平方和、线性图(或其他数学模型)。
七、范围
范围系指分析方法能达到精密度、准确度和线性要求时的高低限浓度或量的区间。范围应根据分析方法的具体应用及其线性、准确虚、精密结果和要求确定。原料药和制剂含量测定,范围一般为测定浓度的80%~120%;制剂会量均匀度检査,范围一般为测定浓度的70%~130%,特殊剂型,如气要剂和喷要剂,范围可适当放宽;溶出度或释放度中的溶出量测定,范用一般为限度的+30%,如规定了限度范围,则应为下限的-20%至上限的+20%;杂质测定,范围应根据初步实际测定数据,拟订为规定限度的±20%。如果一个试验同时进行含量测定和纯度检查,且仅使用100%的对照品,线性范围应要盖杂质的报告水平至规定含量的120%
在中药分析中,范围应根据分析方法的具体应用和线性、准确度、精密应结果及要求确定。对于有毒的、具特殊功效或药理作用的成分,其验证范围应大于被限定含量的区间,溶出度或释放度中的出量测定,范围一般为限度的+30%。
八、耐用性
耐用性系指在测定条件有小的变动时,测定结果不受影响的承受程度,为所建立的方法用于常规检验提供依据。开始研究分析方法时,就应考虑其而电件,如果测试条件要求营教,则应在方法中写明,并注明可以接受变动的范用,可以先采用均勾设计确定丰要影响因衰,再通过里因家分析兰确宗变动范用,典型的变动因素有被测溶液的稳定性、样品的提取次数、时间等,液相色谱法中典型的变动因老有流动相的组成和oH值,不同品牌或不同批号的同类型色谱柱、桂温、流速等。气相色谱法变动素有不同品牌或批号的色谱柱、不同类型的担体、载气流速、桂温、进样口和检测器温度等。
经试验,测定条件小的变动应能满足系统适用性试验要求,以确保方法的可靠性。
来源:CDE
 咨询热线:400-888-1942
咨询热线:400-888-1942




