本指导原则适用于细胞类制品风险放行的快速微生物(细菌/真菌)检查。 本原则所述细胞类制品主要指经过适当的体外操作(如分离、培养、扩增、基因修饰等)制备后回输人体,按药品批准上市的人体来源的活细胞制品。细胞类制品在无菌工艺下生产,生产过程中无法进行除菌和(或)灭菌,产品和工艺本身特性容易受到微生物污染。因此,微生物的污染检查是制品安全性质控的重要指标之一。
药品通常采用无菌检查法(通则 1101)进行微生物污染的评价,需要至少14 天的培养观察微生物生长培养信号。细胞类制品由于效期短,产量小,可供检验的数量有限,生产与临床需求结合更为紧密,采用无菌检查法可能无法保证在制品使用前完成放行检查,且取样方案受限。因此在风险评估的基础上,细胞类制品有条件地采用快速微生物检查法替代经典无菌检查法已成为安全性质控的必要手段。
随着微生物分析技术的发展,制药领域引入了多类快速微生物检测方法,如通则 9201 药品微生物检验替代方法指导原则(指导原则 9201)中介绍的:检测培养生长信号的技术(例如呼吸信号技术等);直接检测微生物的技术(例如固相细胞术、核酸扩增等);结合了预培养和直接检测的技术(例如生物发光技术等)。与传统方法相比,快速方法在检测速度、自动化、实时监测、信息化方面具有一定的优势,不仅可用于生产过程中的质量控制,也可基于风险评估有条件地应用于成品的放行检查。快速微生物检测方法在药品质量控制方面的应用历史较短,在检测的广谱性、灵敏度等方面积累的数据有限,因此应用前需进行充分的评估。除细胞类制品风险放行检查外,本指导原则也可在经验证、评估的前提下,应用于细胞类制品生产过程控制、或其他生物制品生产过程控制中细胞基质等的微生物污染检查。
基本原则
采用快速微生物检查法进行细胞类制品的微生物放行检查,应在充分考虑产品生产工艺、无菌保障水平、微生物污染风险、使用者获益/风险、检测方法原理、同行评议经验等因素的基础上,经风险评估后有条件地施行。微生物质控项目的放行决策应基于产品工艺整体的防污染控制策略及其结果,而非仅依赖于成品的快速微生物方法检查结果。对于拟采用的快速微生物检查法,应先按照《药品微生物检验替代方法验证指导原则》(指导原则 9201)的要求,结合细胞类制品的应用场景、方法原理、检测信号、仪器及试剂盒信息等条件,对方法流程(例如取样、预培养、前处理、仪器读数等步骤)进行评估,确定验证所需覆盖的范围,实施替代方法验证。进行仪器的设计确认、安装确认、运行确认和性能确认,完成替代方法的方法学验证。如因产量、效期等因素限制,无法获得充分的细胞类制品用于方法学验证时,可在风险评估的基础上,采用不含制品成分的试验菌悬液,或者含有模拟基质的试验菌悬液进行方法学验证,并在应用于具体品种前,采用制品加标试验菌的方式进行方法适用性试验,用以考察方法是否适用于该制品的检查。采用本指导原则所述的呼吸信号法时,基于该方法在行业已开展的验证和应用实践情况,可在完成仪器确认后,直接进行方法适用性试验。供试品应能代表产品的所有组分,并从最终成品中取样。如无法进行最终成品取样或最终成品取样存在局限时,需采用其他替代取样方案,应考虑工艺特点,充分评估取样点设计与产品质量控制之间的风险,并得到验证数据的支持。当采用本指导原则进行生产过程中间的质控时,应从相应质控点取样。冷冻可能导致微生物活力受损,冷冻保存的细胞类制品建议在冷冻之前的最后工序后,完成取样和检验。细胞类制品的微生物检查应在无菌条件下进行,检验的全过程应严格遵守无菌操作,防止微生物污染,防止污染的措施不得影响供试品中微生物的检出。试验环境应符合无菌检查法(通则 1101)和药品微生物实验室质量管理指导原则(指导原则 9203)的要求。当制品检出污染菌时,应对污染菌进行鉴定,进一步评估其对产品质量的影响,鉴定方法可参考微生物鉴定指导原则(指导原则 9204)。当检查结果发生争议时,仲裁方法为无菌检查法(通则 1101)。
推荐方法第一法(呼吸信号法)
原理
本指导原则所述方法为快速微生物检查法,主要适用于效期短、批量小,采用现行无菌检查法(通则 1101)无法保证在产品使用前完成放行检查的细胞类制品。此处列举目前行业较为普遍应用的呼吸信号法。呼吸信号法系基于检测微生物生长信号的仪器方法,采用商品化全自动微生物培养系统,通过仪器实时监测微生物生长代谢产生的二氧化碳引起的培养瓶内反应底物的显色或荧光变化信号,或培养瓶顶空压力变化信号,结合目视观察,判定供试品中有无微生物生长。呼吸信号法以往多应用于临床血液/体液标本的检测,系目前较为普遍应用于细胞类制品类制品放行检验的一类快速微生物检查方法。鉴于该方法使用仪器进行微生物培养和生长监测,为确保仪器的稳定可靠,应定期对其关键性能(例如培养箱的温控性能)进行验证;对关键传感器(例如温度探头,孔位传感器)的状态进行校准或确认。
培养基
本法所用培养基为商品化的仪器适配的培养基,应参照无菌检查法(通则1101)对每批培养基进行培养基适用性检查并符合产品相关规定。至少应有 2种适宜培养基用于检测真菌、需氧细菌和厌氧细菌。培养基的适用性检查应包括无菌性检查和灵敏度检查。试验菌株的选择按照“方法适用性试验”项下的要求,检测真菌、需氧细菌和厌氧细菌的培养基应分别接种不大于 100 CFU 的试验菌,置于系统确认的培养温度下培养。除痤疮丙酸杆菌外,接种细菌的培养基应在 3天内生长良好,接种真菌的培养基应在 5天内生长良好,接种痤疮丙酸杆菌的培养基应在 7 天内生长良好。
方法适用性试验
采用本法进行产品快速微生物检查时,应进行方法适用性试验,以确认所采用的方法适用于该产品。若检验程序或产品发生变化可能影响检验结果时,应重新进行方法适用性试验。应采用至少 2 个批次的供试品进行方法适用性试验,每批供试品应至少平行进行 3 个重复的独立实验。方法适用性试验按下列要求进行操作。对每一试验菌应逐一进行方法确认。菌种及菌液制备 应至少包含表 1 中的试验菌种。必要时,根据产品的来源、特点及产品既往微生物污染情况,可增加相应的菌株。金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌、生孢梭菌、枯草芽孢杆菌、白色念珠菌和黑曲霉的菌液制备方法见无菌检查法(通则 1101)。接种酿脓链球菌的新鲜培养物至胰酪大豆胨液体培养基中,30~35℃培养 2~3 天;接种藤黄微球菌的新鲜培养物至胰酪大豆胨液体培养基,30~35℃培养 3~4 天;接种痤疮丙酸杆菌的新鲜培养物至硫乙醇酸盐流体培养基中,30~35℃培养 6~7 天,上述培养物用 pH7.0 无菌氯化钠-蛋白胨缓冲液或 0.9%无菌氯化钠溶液,制成适宜浓度的菌悬液。除痤疮丙酸杆菌外,细菌悬液的计数采用胰酪大豆胨琼脂培养基,痤疮丙酸杆菌悬液的计数采用血琼脂培养基;真菌悬液的计数采用沙氏葡萄糖琼脂培养基。

接种及培养 取仪器适配的培养基 2 组,其中 1 组按照“供试品的快速微生物检查”项下的方法,每个培养管分别加入供试品,再分别接种不大于 100 CFU 的各试验菌,另 1 组培养基,加入等量的各试验菌作为对照组。2 组培养基均置于仪器内进行培养,除另有规定外,培养时间不得超过 7 天。
结果判断与对照组相比,接种供试品和试验菌的培养基组在仪器内均应显示为阳性结果,且目视观察生长良好,不能出现因为生长微弱、缓慢而导致仪器报告阳性的时间明显滞后的现象。否则说明供试品存在抑菌作用,应采用适当方法消除供试品的抑菌作用,重新进行方法适用性试验。
供试品的快速微生物检查
取样及检验量 供试品取样按照基本原则的要求进行。对于单个容器且总体积(V)在 1ml~1L 的单一批次细胞制剂,供试品的最少检验量不应低于表 2;中间产品有多个容器时,每个容器应分别取样进行检测。取样后应尽快将供试品接种至培养基,如供试品需存放,应评估存放的潜在污染风险,以及存放对检出效果的影响。
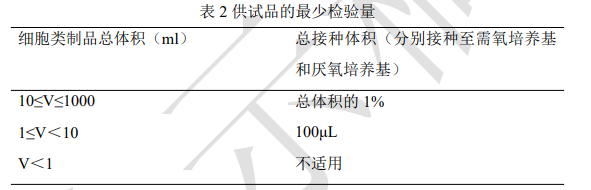
对于总量小于 1ml 的单一批次产品,上述取样方式不适用,可经评估后采用替代取样方案、过程检查或其他适宜方式。供试品处理及接种培养基 用适宜的方法对供试品包装容器表面进行彻底消毒,在无菌条件下抽取规定量供试品,分别等量接种至仪器适配的每种培养基内,每个容器中接种的供试品体积、培养基的装量和高度同方法适用性试验。除另有规定外,每个容器接种的供试品与培养基体积的比例不应超过仪器说明书的规定。
阳性对照 应根据供试品特性和方法适用性试验的结果,选择至少一种阳性对照菌,并评估阳性对照瓶在仪器中培养后报告阳性结果的时间范围。应选择受供试品影响而导致仪器检出明显滞后的试验菌作为阳性对照菌,无抑菌现象的供试品以金黄色葡萄球菌作为阳性对照菌,阳性对照瓶加菌量不大于 100 CFU,加入的供试品用量同供试品微生物检查时每份培养基接种的样品量。阳性对照瓶在经验证的时间期限内培养,应为阳性结果。
阴性对照 供试品快速微生物检查时,应取相应溶剂、稀释液、或冲洗液同法操作,作为阴性对照。阴性对照应为阴性结果。培养及观察 将供试品接种至培养基后,应按照仪器说明书的时间要求尽快置于仪器中培养。培养时间应不少于 7 天,根据方法适用性试验结果及特殊相关微生物的情况,可延长至 14 天。
仪器的培养温度应依据方法适用性试验结果而定,应能检测到尽可能多的微生物,培养温度范围通常为 30~37℃。根据产品的来源、特点、既往发生过的或与特定细胞类型相关的微生物污染情况具体考虑,对于存在较高环境污染风险的产品,可增加一个需氧条件的温度培养范围,如 20~25℃,以便能覆盖更多的微生物。
结果判断 在培养期间定期及结束培养时,按照说明书对仪器进行检查,并同时进行目视观察。若仪器判定各供试品管均为阴性结果,且目视观察判断无微生物生长迹象,则供试品可判为符合规定。若仪器判定有供试品管为阳性结果,且目视观察判断有微生物生长迹象,则供试品判为不符合规定。若仪器判定供试品管为阴性结果,但目视观察疑似微生物生长现象,或仪器判断为阳性结果,但目视观察未发现微生物生长迹象,出现以上两种情况时,取该培养物不少于 1 ml 转种至同种新鲜培养基中,将原始培养物和新接种的培养基继续培养不少于 4 天,观察接种的同种培养基是否再出现微生物生长迹象;或取培养液涂片,染色,镜检,判断是否存在微生物生长。如目视观察发现或涂片发现微生物生长迹象,判供试品不符合规定。
上述任何一种情况下如判供试品不符合规定,除非能充分证明试验结果无效,即生长的微生物非供试品所含,方可对供试品进行重试,重试时,应重新取同量供试品,依法检查,结果判定同上。应至少符合下列条件之一,判为试验无效:
(1) 试验所用的设备及环境的微生物监控结果不符合无菌检查法的要求。
(2) 回顾试验过程,发现有可能引起微生物污染的因素。
(3) 在阴性对照中观察到微生物生长。
(4) 供试品管中生长的微生物经鉴定后,确证是因试验中所使用的物品和(或)无菌操作技术不当引起的。
第二法 ATP 生物发光法
原理
三磷酸腺苷(ATP)是生物活细胞(包括微生物)新陈代谢中的标志性分子,可作为微生物污染的检测指标。ATP 生物发光法是一种结合了预培养步骤和 ATP 生物发光检测步骤的微生物快检方法,可用于细胞类制品微生物污染的定性检查。本法通过将供试品接种液体培养基,经预培养后取样,通过细胞裂解处理使活微生物细胞释放胞内 ATP, 在荧光素酶的催化下,ATP 与荧光素及氧分子发生生物发光反应,采用光度计检测光信号强度,判读供试品中是否存在微生物污染。
本法可采用无菌检查法(通则 1101)的供试品前处理方式,适用于较大体积的供试品,且通过预培养提升灵敏度,可在微生物早期生长阶段进行检测,避免供试品自身浑浊对检测的干扰。本法用于细胞类制品时,还需关注其特殊风险,如制品中高密度活细胞含有大量内源性 ATP 导致的假阳性结果,以及供试品或反应体系中可能存在抑制生物发光的因素导致的假阴性结果等。
为确保检测结果的准确性与可靠性,本法应在供试品接种前或生物发光反应前的适宜步骤,建立并验证有效的细胞前处理方法,以消除细胞源性 ATP 干扰,以及其他潜在干扰因素;试验所用的培养基、稀释液、冲洗液、细胞裂解液等试剂,应选择低 ATP 背景水平的产品,以降低检测时的背景信号干扰;应确保所用仪器性能稳定可靠,建议采用已知 ATP 浓度的溶液进行校准或状态确认,本法通常使用商品化仪器及配套试剂,其使用应符合制造商规定,并满足本法的检测要求。
培养条件与培养基适用性检查
预培养步骤所采用的培养基,应基于风险考虑,满足广谱的需氧细菌、厌氧细菌和真菌检出要求,可采用无菌检查法(通则 1101)的培养基,或其他经验证的培养基。对于需氧微生物的预培养温度,可选择 20°~25°C或 30°~35°C范围;对于厌氧微生物的预培养温度,可选择 30°~35°C。在合适情况下,可基于产品的来源、工艺特点、污染风险等评估,选择更多培养温度范围,以利于检出与产品/工艺相关的潜在污染微生物。培养基的适用性检查应包括无菌性检查和灵敏度检查,应参照无菌检查法(通则 1101)对每批培养基进行无菌性检查。灵敏度检查的试验菌株可采用第一法(呼吸信号法)中所推荐的菌株。检测真菌、需氧细菌和厌氧细菌的培养基应分别接种不大于100 CFU的试验菌,按

方法适用性试验
在采用 ATP 生物发光法前,应按基本原则章节的要求,开展替代方法验证,确认其作为药典方法替代的可行性,验证范围应包括预培养步骤,生物发光检测等步骤在内的流程。将本法应用于细胞类制品时,还应研究供试品细胞源性 ATP 分子带来的检测干扰问题,选择具有代表性的供试品细胞规格(或经评估可供模拟的其他细胞),开发并验证相应的细胞前处理方法。在完成作为药典替代方法的验证,以及细胞前处理方法的开发后,本法应用于不同的细胞类制品时,还应开展独立的方法适用性试验。细胞前处理方法的开发及验证 为消除细胞源性的 ATP 分子对微生物检测的干扰,可开发并验证适宜的细胞前处理方法(可参考表 4)。

在细胞前处理方法开发时,应确立方法的关键操作参数,包括但不限于:
前处理的介入时机、多种策略的联用方式、细胞裂解液的处方与裂解条件、过滤/冲洗条件、ATP 分子酶解条件、前处理方法可适用的细胞浓度范围;最终检测微生物时的生物发光反应阳性阈值设置的合理性。同时,前处理方法的操作方式应注意尽量避免引入外源污染。前处理方法的验证应在挑战性条件下进行(例如较高的细胞浓度,较短的预培养时间,较低的预培养温度等),以充分考察方法的性能;应证明可有效消除供试品细胞假阳性信号干扰,且不影响低浓度污染微生物(例如选择 10 CFU加标水平的挑战)的有效检出。如经充分开发与验证,仍无法建立满足上述要求的前处理方法,表明本方法可能不适用于该细胞类制品,建议考虑采用其他微生物检测方法。如所开发的细胞前处理方法,可能导致方法中其他流程,例如预培养体系、试剂盒类型、仪器设置参数等的重大变化,则应充分评估该步骤对整个方法体系的影响,必要时应重新进行替代方法的方法学验证。其他影响因素的考虑 除供试品细胞源性的 ATP 分子干扰外,在方法适用性试验中,还需考虑其他可能影响微生物检出的因素,例如处方中可能的抑菌因素或抑制生物发光反应的因素,从预培养物中取样方案的合理性(例如评估霉菌或慢生长菌培养初期的取样漏检风险)。
试验菌株 应至少包括培养基适用性检查规定的菌株。必要时可根据产品的来源、工艺特点及产品既往污染历史,增加相应的菌株,例如慢生长菌,风险较高的环境污染菌。预培养时长的设置 应基于替代方法验证中对试验菌生长特性的研究结果,设置合适的预培养时长。需评估预培养时长可能造成的影响,例如取样过早可能导致微生物未能充分生长的假阴性风险,取样过晚造成的制品放行延误风险。方法适用性试验的实施 按下列分组开展方法适用性试验。
(1)试验组:取规定量供试品,接种不大于 10CFU 的试验菌,按建立的方法检测:采用直接接种法或薄膜过滤法处理后接种培养基,进行预培养,期间应按已开发的细胞前处理方法处理,上机读数。
(2)供试品对照组:取规定量供试品,不接种试验菌,与试验组同法处理。
(3)菌液对照组:取不大于 10CFU 的试验菌,与试验组同法处理。
(4)阴性对照组:取空白稀释液接种培养基,与试验组同法处理。
结果判断 在设定的预培养时长取样检测,结果应符合以下标准:试验组、菌液对照组读数均应大于预设阳性阈值,报告阳性;供试品对照组、阴性对照组读数均应小于预设阳性阈值,报告阴性。
其他结果分析与采取措施 如试验组未报告阳性,或报告阳性时间较菌液对照组明显延迟,表明供试品可能存在未消除的抑菌性或抑制生物发光因素,应采取中和、稀释、冲洗等方法消除干扰后,再进行方法适用性试验。如菌液对照组未报告阳性读数,说明细胞前处理方法可能影响微生物回收,应重新开发、验证细胞前处理方法后,再进行方法适用性试验。如供试品对照组报告阳性读数,但经确认并非微生物所致,说明供试品细胞源性 ATP 分子的干扰未被充分消除,应重新开发、验证细胞前处理方法后,再进行方法适用性试验。如阴性对照组报告阳性读数,说明培养基、稀释液、细胞裂解液等试剂中可能存在外源 ATP 污染,应排除污染后,再进行方法适用性试验。供试品的快速微生物检查取样及检验量 供试品取样,按照基本原则和第一法(呼吸信号法)下取样及检验量的要求进行。
供试品预培养时间的确定 本法为预培养后人工取样、仪器离线检测的方法,培养时长的确定应考虑真实世界中污染菌的漏检风险,待检产品的培养时长不得短于方法适用性试验中最慢生长菌的培养时长,并增加必要的安全冗余量。供试品处理 用适宜的方法,对供试品包装容器表面进行彻底消毒,在无菌条件下抽取规定量供试品,分别等量接种至各培养基容器内,每个容器中接种的供试品体积、培养基的装量和高度同方法适用性试验。将培养基置于经方法适用性试验确认的培养温度,培养至确定的预培养时长后取样,期间应按已经验证的细胞前处理方法处理,上机检测。培养物取样和前处理过程应采用无菌操作,避免引入外源污染。
阳性对照 应根据供试品特性和方法适用性试验的情况,选择至少一种阳性对照菌。应选择受供试品影响导致阳性报告延迟的试验菌作为阳性对照菌,未发现明显抑菌现象的供试品以金黄色葡萄球菌作为阳性对照菌。阳性对照瓶加菌量不大于 10CFU,加入的供试品用量同检查时每份培养基的接种量,与供试品培养瓶同法操作,作为阳性对照。
阴性对照 应取相应溶剂、稀释液、或冲洗液同法操作,作为阴性对照结果判断 若仪器判定供试品预培养物的读数小于阳性阈值,且目视观察培养管判断未见微生物生长迹象,则供试品可判为阴性。若仪器判定供试品预培养物的读数超过了阳性阈值,不论目视检查培养管是否存在疑似微生物生长迹象;或仪器判定供试品预培养物的读数小于阳性阈值,但目视观察培养管疑似出现了微生物生长迹象,均应取该培养物不少于 1ml 转种至同种新鲜培养基中,将原始培养物和新接种的培养基继续培养不少于4天,观察接种的同种培养基是否再出现微生物生长迹象;或取培养液涂片,染色,镜检,判断是否存在微生物生长。试验无效及重试条件的判定,参照无菌检查法(通则 1101)执行。
修订说明
本指导原则修订由上海市药品检验研究院起草,浙江省食品药品检验研究院、中国食品发酵工业研究院、广东省药品检验所,深圳市药品检验研究院复核。主要增修订情况如下:
1、根据药品微生物快速分析技术在国内外的发展及在新型生物制药领域应用的推广,引进更多微生物快检方法用于细胞类制品生产过程中细胞基质的微生物污染控制等方面。本指导原则增订第二法(ATP 生物发光法),该法为结合了液体培养基预培养步骤和 ATP 生物发光步骤的微生物快检方法。原有已收载的推荐方法(呼吸信号法)修订为第一法。
2、增订的第二法主要内容包括方法原理、培养条件与培养基适用性检查、方法适用性试验(包括细胞前处理方法的开发、建立和验证)、供试品的快速微生物检查等。重点提示该法应用于细胞类制品时的风险考虑,包括供试品细胞源性 ATP 分子的假阳性干扰风险;供试品处方中其他干扰因素;操作可能引入的外源污染风险;培养时长与真实污染漏检风险等,并针对这些风险,在方法验证、适用性试验、日常检查等环节提示相应的处理策略和应用注意事项。
3、在“基本原则”章节,完善了替代方法验证的要求。
起草单位:上海市药品检验研究院
联系电话:021—50798176
起草单位:上海市药品检验研究院
来源:药典委
 咨询热线:400-888-1942
咨询热线:400-888-1942




