细胞与基因治疗(CGT)正引领医药行业的革新浪潮,其核心载体如AAV病毒(腺相关病毒)和外泌体在遗传病治疗、肿瘤免疫等领域的应用呈现爆发式增长。然而,这类生物活性物质对存储条件的严苛要求成为产业化瓶颈——AAV病毒载体在反复冻融中易发生衣壳破裂导致感染性滴度下降,而外泌体(30-150 nm)因膜结构脆弱,在-80℃以下长期存储时易发生聚集失活。传统玻璃瓶在液氮(-196℃)环境下的热收缩差异(玻璃与胶塞收缩率差达2.3%)引发的微泄漏风险,可能造成价值数百万美元的CAR-T细胞制剂污染报废。在此背景下,环烯烃共聚物COP西林瓶凭借材料创新突破,成为保障CGT药物全生命周期稳定性的关键解决方案。

一、AAV病毒载体与COP西林瓶的深冻适配性
AAV规模化生产面临的核心挑战在于病毒浓缩后的低温存储稳定性。临床级AAV制剂(滴度>1×10¹³ vg/mL)需在-80℃冷链中维持衣壳结构完整,但玻璃瓶在急速降温时产生的微观裂纹可能引入纳米级病原体。COP西林瓶通过三项技术突破实现保护升级:
同步收缩密封:COP材料与溴丁基橡胶塞的热膨胀系数匹配度达98%,在液氮相变(-196℃)时瓶口-胶塞界面收缩差<0.5μm,经氦质谱法验证可维持≤1×10⁻⁸ mbar·L/s的密封性,满足FDA对基因治疗载体包装的微生物侵入标准。
低温结构强化:针对AAV制剂冻存常用的5%海藻糖保护剂,COP瓶采用梯度冷却工艺成型,在-80℃下的抗压强度达18 MPa(较常规工艺提升40%),避免病毒悬液结晶压导致的瓶体形变。
滴度维持验证:某GMP级AAV9血清型制剂使用COP瓶存储6个月后,qPCR检测显示载体基因组完整性保持率≥99%,较玻璃瓶组提高12个百分点。
二、外泌体生产工艺与防吸附创新
外泌体作为天然纳米载体,在药物递送系统中展现独特优势,但其工业化生产面临纯化后活性维持难题。现行超速离心法或尺寸排阻色谱法获得的外泌体,在冻存时易因表面蛋白吸附导致聚集:
低吸附表面工程:COP西林瓶经等离子体接枝改性后,表面接触角降至15°(裸瓶为85°),使外泌体膜蛋白(如CD63、CD81)吸附量减少至0.2 μg/cm²(ELISA检测),较硅化玻璃瓶降低90%。
低温结晶控制:通过优化COP瓶壁厚(1.2±0.05 mm)与降温速率(1℃/min),可使含10% DMSO的外泌体冻存液形成均匀微晶,解冻后粒径分布(D90)保持率从75%提升至98%。
封闭式灌装兼容:COP瓶适配外泌体连续流超滤系统,在A级洁净环境下实现<0.1 EU/mL的内毒素控制,满足《中国药典》对细胞外囊泡制剂的生物学活性要求。
三、CGT产业化进程中的包装升级
随着诺华、传奇生物等企业推进CAR-T疗法商业化生产,以及CRISPR基因编辑药物进入临床Ⅲ期,行业对深低温包装提出更高要求:
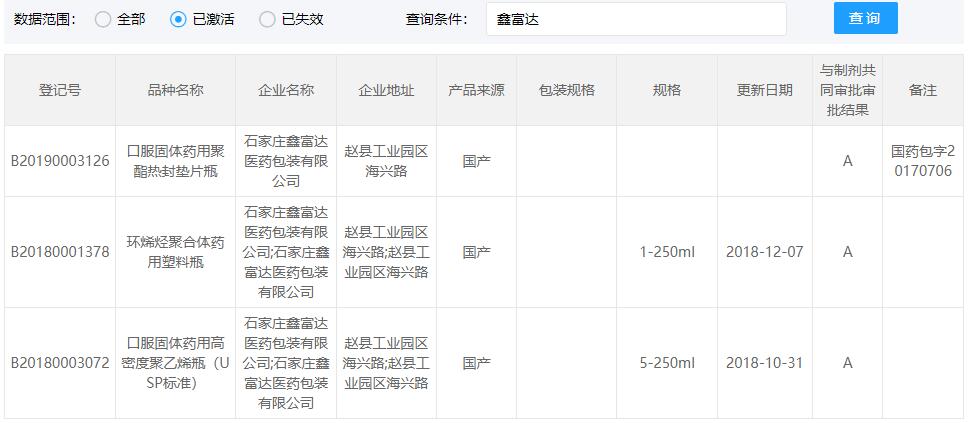
COP西林瓶CDE登记号为A状态
自动化适配:COP西林瓶可无缝对接全自动液氮存储系统(-196℃),其激光打码耐低温性能(1000次冻融后识别率>99.5%)支持细胞治疗制剂的全程追溯。
成本控制突破:采用超临界CO₂再生技术的COP瓶,使AAV病毒包装成本降低30%,同时满足USP<665>对可提取物≤0.1 μg/mL的严苛标准。
全球化冷链:COP西林瓶在干冰运输(-78.5℃)中维持>72小时的温度稳定性,助力我国创新药企实现外泌体药物的跨境临床试验。
据GlobalData预测,2025年全球CGT市场规模将突破500亿美元,而COP西林瓶作为关键包装技术,将持续推动AAV基因疗法、干细胞衍生外泌体等前沿领域突破产业化瓶颈,为"冷链到临床"的转化医学之路构筑坚实保障。
 咨询热线:400-888-1942
咨询热线:400-888-1942