要系统论证辐照灭菌后的COP西林瓶对蛋白类药物吸附率未产生显著影响,关键在于设计一套严谨的对比实验,并聚焦于关键质量属性的量化分析。以下是一个可供参考的实验框架和核心评价指标。
COP西林瓶
实验设计核心要点
样品分组准备
实验组:辐照灭菌后的COP西林瓶(建议使用经过25 kGy伽马射线辐照处理的瓶子)。
对照组:未经辐照的同一批次COP西林瓶。
参考对照组:常用的硼硅玻璃西林瓶(可选,用于横向对比评估COP材料的固有优势)。
为确保结果可比性,所有西林瓶应来自同一生产批次。
模型蛋白选择
选择与您实际产品性质相近的模型蛋白。常见的代表性蛋白包括:
单克隆抗体(如IgG):代表大分子治疗性蛋白。
牛血清白蛋白(BSA):性质稳定,常用于方法学开发。
溶菌酶:代表小分子蛋白
将模型蛋白溶解在与实际药液相似的缓冲体系(如PBS缓冲液)中,并配制确定的初始浓度(如1 mg/mL)。
吸附实验过程
向各组西林瓶中注入等量、等浓度的蛋白溶液。
在可控的温度(如2-8°C、25°C)下,放置预定时间(如0、24、48小时,或更长至数周,以模拟实际接触时间)。
到达预定时间点后,小心吸取西林瓶中的溶液,准备检测。
关键分析指标与方法
对接触前后的蛋白溶液进行精准分析是证明无显著吸附的核心。
蛋白浓度定量分析
使用高精度的分析方法测定回收蛋白浓度,最常用的是BCA蛋白测定法或紫外分光光度法(A280 nm)。
计算公式:蛋白吸附率 (%) = [(初始浓度 - 回收浓度) / 初始浓度] × 100%
预期结果:若辐照未引起显著变化,则实验组(辐照后COP)的吸附率应与对照组(未辐照COP)无统计学显著差异,且显著低于参考对照组(玻璃瓶)。有研究表明,高质量COP瓶的蛋白吸附率可控制在≤0.05 μg/cm²的水平。
蛋白结构与功能完整性评估(进阶验证)
高效液相色谱(HPLC):特别是尺寸排阻色谱(SEC-HPLC),用于检测蛋白是否发生聚集或降解。
圆二色谱(CD):分析蛋白的二级结构(如α-螺旋、β-折叠)是否发生变化。
生物活性测定:如果条件允许,进行细胞实验等生物活性分析,确保蛋白功能未受损。
西林瓶表面性质分析
表面能/接触角测定:评估辐照是否改变了COP内表面的疏水性/亲水性,这是影响蛋白吸附的关键物理性质。
显微镜检查:观察内壁是否有物理损伤或沉积物。
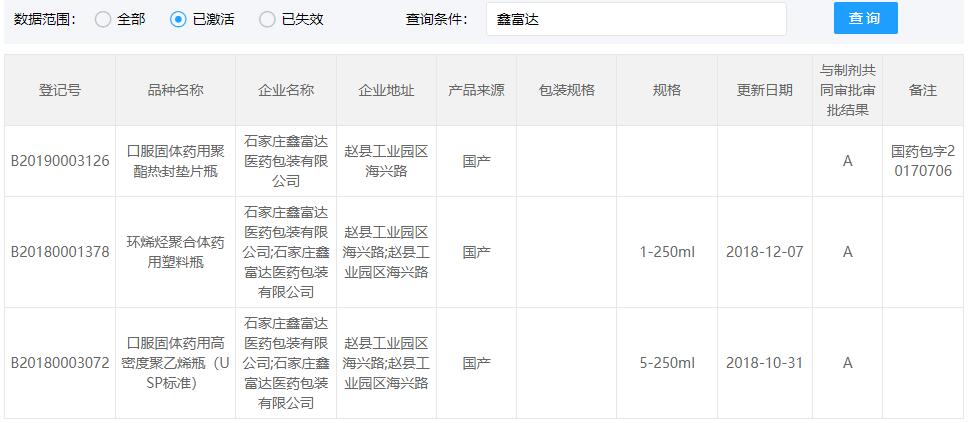
COP西林瓶CDE登记号为A状态
数据解读与结论
统计分析:使用t检验或方差分析(ANOVA)等统计方法,比较实验组与对照组吸附率的差异是否具有统计学显著性(通常以 p< 0.05 为阈值)。
临床相关性判断:即使观察到微小的吸附差异,也需评估该差异是否在药品质量标准的可接受范围内,是否会影响给药的准确性和安全性。通常,吸附率变化控制在1-2%以内可认为无显著临床影响。
综合结论:如果数据显示,辐照后的COP瓶在蛋白吸附关键指标上与未辐照瓶无显著差异,且其吸附率远低于传统包装材料,即可有力证明辐照灭菌工艺并未对COP西林瓶的低蛋白吸附特性产生不良影响。
确保实验可靠性的建议
设置重复:每个实验条件应设置足够的平行重复样本(如n=3或更多),以确保数据的可靠性和重现性。
空白对照:设置不含蛋白的缓冲液空白对照,以排除缓冲液本身或容器可能带来的背景干扰。
方法验证:在正式实验前,对所使用的蛋白浓度定量方法进行必要的方法学验证,确保其准确、精密。
 咨询热线:400-888-1942
咨询热线:400-888-1942