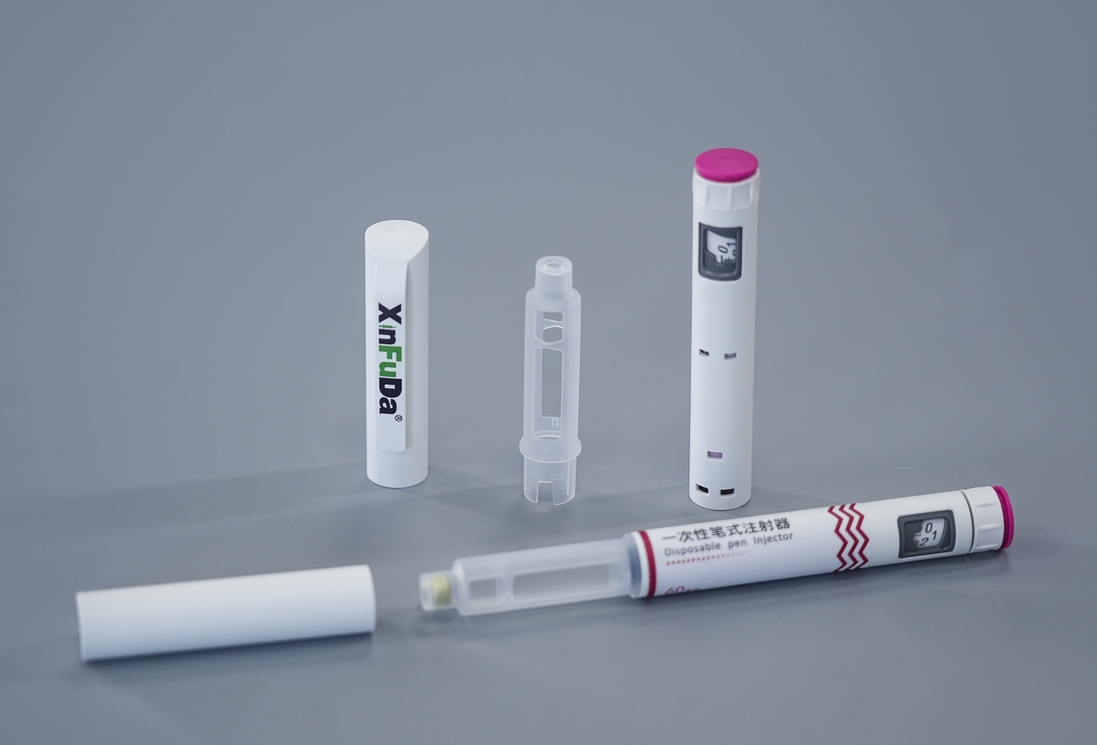
在高效、便捷给药方式快速发展的当下,笔式注射器从普通工具跃升为精准药物递送平台。它不仅支持患者进行自主治疗管理,其与特定药物的匹配性及配套法规要求更是制药研发关键挑战。理解这种精妙结合对于开发现代治疗手段至关重要。
一次性笔式注射器
生物制剂与大分子药物:抗体类药物与蛋白药物的黏度明显高于普通水剂,对注射系统的推力要求更高。同时,这些药物易因剪切力出现结构变化、蛋白聚集等问题,因此选择相容性优异的储药桶(如特制中性硼硅玻璃)及低阻力推杆系统尤为重要。使用前还需经过严格的剪切稳定性及亚可见微粒研究(例如模拟注射过程的稳定性测试、光学粒子扫描检验微粒数量)。
长期慢性疾病用药:糖尿病长效胰岛素需每日多次注射,胰岛素/GLP-1类复方制剂为长效控糖组合,均高度依赖可反复使用的笔式注射器平台,便于患者随时携带和操作。此类设备优化重点包括便捷剂量调节(步进按钮精度±0.5单位)、防误触保护锁及显著剩余剂量提示(如视窗设计)。
个性化剂量药物:部分激素(如促卵泡激素FSH)及特定生长因子治疗需根据患者生理指标实时调整剂量,因此笔式注射器需内置连续、精细且可靠(±3% 注射偏差内)的调节旋钮机制,确保每次注射按毫克级别准确调整。
复杂溶液/悬液匹配:部分药物需在装置内即时混合双组分(冻干粉/溶媒),注射平台需提供稳定混合通道(如内部管道优化设计减少堵塞),避免长时间滞留导致药物微粒析出问题。

笔式注射器规格
笔式注射器作为药械组合类产品,开发过程需满足以下核心法规要求:
药品法规适配性要求(核心):
相容性要求(全面验证):严格参照CDE指南(《化学药品注射剂包装系统密封性研究技术指南》)和FDA指南(e.g., Container Closure Systems for Packaging Human Drugs and Biologics),进行可提取物/浸出物研究,测试极端条件下包材中是否有物质迁移入药液(如高温提取实验),并验证对药物的化学纯度与功效成分有无影响(强制液相色谱-质谱联用测试)。
功能稳定性(全周期验证):按照ICH Q1A要求完成长期(通常2年)与加速稳定性测试(40°C/75%湿度下6个月),确认药剂从储存至使用结束全过程中装置无泄漏(真空色水法密封验证)、剂量精度稳定(注射100次的重复性测试)。同步验证装置的机械磨损耐受度(如推杆5万次耐久验证)。
给药精度(严格测试):需满足欧洲药典(如EP 3.2.9)、美国FDA指南(如Guidance on Injection Pen Performance)对剂量准确度和精密度要求(±5% 精度范围),尤其需模拟患者实际使用习惯(如1mL注射器中注射小剂量30uL,确认微剂量控制精度)。
医疗器械基础规范(支撑):
人体安全(严格把控):全组件材料需满足ISO 10993生物相容性基础要求(包括细胞毒性、皮肤致敏性、植入试验等多重安全检测),确保材料与人体接触无过敏或不良反应。
风险管控(主动管理):推行ISO 14971标准的风险管理流程,从设计源头识别所有潜在风险点(如设计缺陷引发剂量错误,标识不清导致误用),建立故障树分析并进行系统化闭环处理。
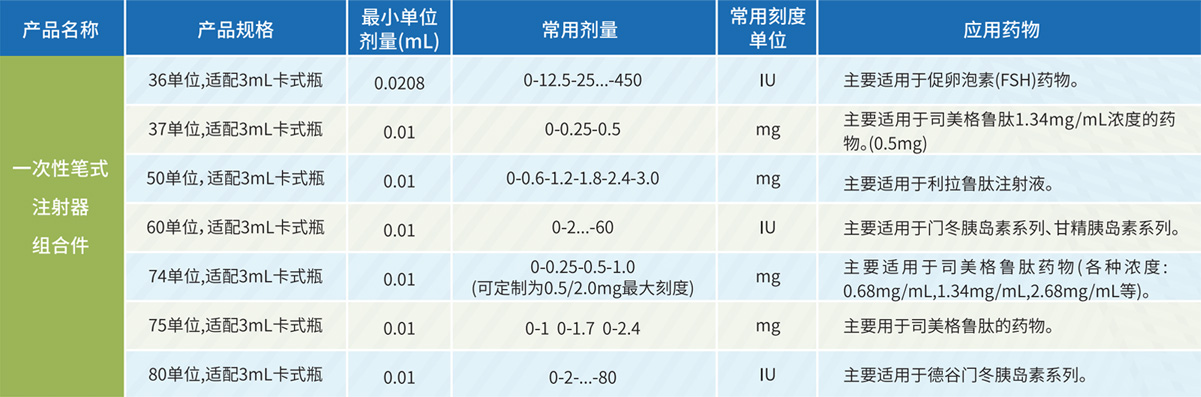
一次性笔式注射器规格
使用性能与人因设计(易用性):依照FDA人因工程指南及欧盟标准EN ISO 62366进行人机交互设计测试(如视障患者使用触觉刻度反馈设计),保障操作安全简便(如单手注射完成率达98%)。
申报策略(灵活规划):需综合考虑地区监管差异(中国新包材需登记审批,美国按PAS补充递交,欧盟进行详细变更评估后许可),并特别关注涉及药械组合产品的联合法规要求(如FDA 21 CFR Part 4)。
智能化整合:通过蓝牙模块实时记录注射数据并传输至手机App(如MyDose Coach系统),提醒患者用药时间、剂量,生成数字化用药日志。
模块化设计:开发可分离式药物储罐设计(如可替换式笔芯),方便病人多次重复使用笔壳,降低成本,减少医疗浪费。
个性化体验:提供可调节注射速度配置(如慢速注射以减少疼痛感)、定制握持部件(针对儿童及老年人设计不同大小),提升药物依从性。
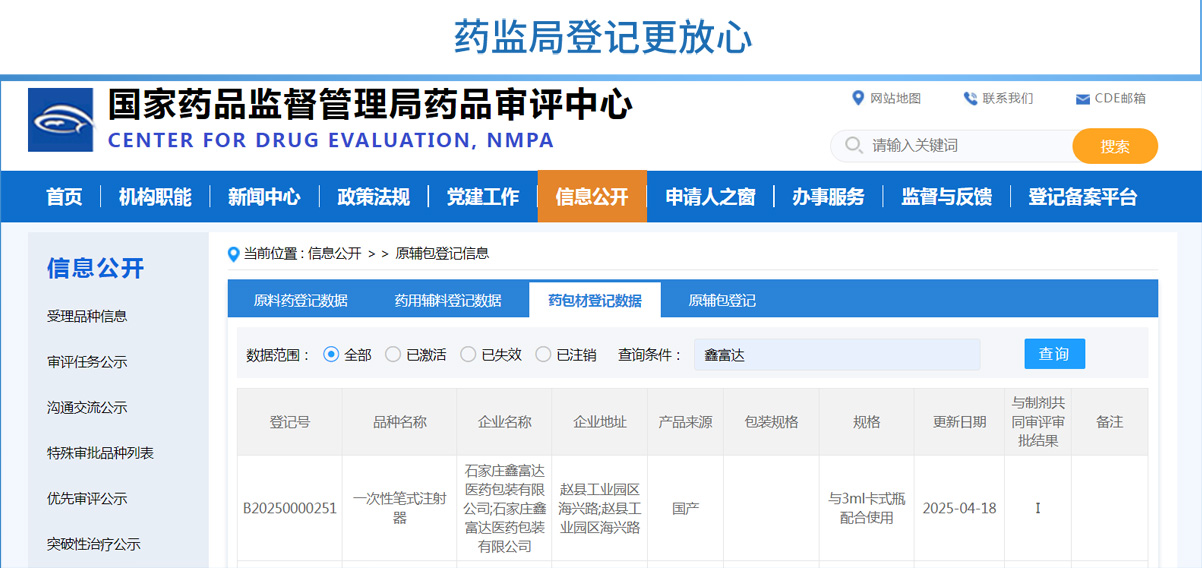
一次性笔式注射器CDE登记号
笔式注射器是尖端药物递送技术的结晶,也是药物-包材-给药方式“三位一体”设计的卓越示范。从生物制剂的黏度适配、个性化药品的剂量精度控制,到满足全球严格安全监管框架(CDE/FDA/EMA),都体现了技术创新背后强大的研发专业能力。随着智能笔与数据平台技术的进步,注射笔系统将成为未来精准化与数字化治疗的核心平台。
文中涉及的指南:
中国CDE:《化学药品注射剂包装系统密封性研究技术指南》
美国FDA:Container Closure Systems for Packaging Human Drugs and Biologics
国际ICH:ICH Q1A(R2) 稳定性测试要求
欧洲药典(EP):注射装置性能标准
ISO标准:ISO 10993(生物相容性)、ISO 14971(风险管理)、ISO 62366(人因工程)
 咨询热线:400-888-1942
咨询热线:400-888-1942