一、政策驱动:植入类医疗器械的包装升级需求
随着《生物医学新技术转化应用实施目录(第二批)》(海南博鳌乐城,2025年)将“可降解骨修复材料”“基因修饰组织工程皮肤”等植入类产品纳入临床应用清单,国家对植入器械的生物安全性、无菌保障及长期稳定性提出更高要求。
法规升级:植入器械包装需满足YY/T 0681.1-2020《无菌医疗器械包装试验方法》中密封完整性测试(如真空衰减法)及ISO 11607-2019对加速老化试验(模拟≥5年有效期)的强制标准。
材料合规性:COP树脂需通过USP <661.1>塑料材料功能性测试、ISO 10993-5细胞毒性测试(细胞活性≥90%),并控制17项基因毒性杂质(检出限≤0.03 μg/mL)。

COP西林瓶
二、技术适配:COP西林瓶如何支撑植入器械安全性与有效性
1. 无菌保障与密封可靠性
免洗免灭工艺:RTU(即用型)COP西林瓶经伽马辐照灭菌(25kGy)后,内毒素≤0.25 EU/mL,直接用于A级灌装环境,避免传统清洗导致的微粒污染(如玻璃脱屑)。
极端密封性:在-196℃液氮存储下,COP瓶与溴丁基橡胶塞组合的氦质谱泄漏率≤1×10⁻⁶ mbar·L/s,经300次冻融循环后开盖力仍维持18-25 N·m,确保植入器械(如冻干骨粉)在运输中零污染。
2. 生物相容性与活性保护
低蛋白吸附(≤0.05 μg/cm²):防止胶原蛋白支架、生长因子(如BMP-2)在瓶壁吸附,保障骨修复材料中活性成分剂量精准性。
抗低温形变:热膨胀系数仅为玻璃的1/10,-196℃急冻时体积变化率≤0.02%,避免人工关节预涂层(如羟基磷灰石)因瓶体冷缩开裂而脱落。
3. 临床场景适配性
快速复融兼容性:薄壁设计(0.8-1.2 mm)结合垂直加强筋,承受60℃水浴复融(2分钟内)的热应力,适用于术中即时解冻的软骨细胞移植制剂。
追溯安全性:内壁激光打码耐液氮侵蚀,实现植入器械从生产至手术台的全程追溯(扫码率≥99.9%),符合《医疗器械唯一标识系统规则》。
三、应用场景:从组织工程到精准植入
1. 组织工程产品
基因修饰皮肤移植物:COP西林瓶在-80℃下储存6个月,表皮生长因子(EGF)回收率≥98%(玻璃瓶≤90%),维持修复活性。
可注射骨修复微球:阻氧性(水蒸气透过率<0.01 g·mm/m²·day)防止β-磷酸三钙颗粒氧化降解,术后骨融合率提升30%。
2. 细胞联合植入物
CAR-T纤维蛋白支架:含10% DMSO的T细胞-纤维蛋白胶复合物,在冻存后细胞存活率>95%,植入后肿瘤靶向效率无衰减。
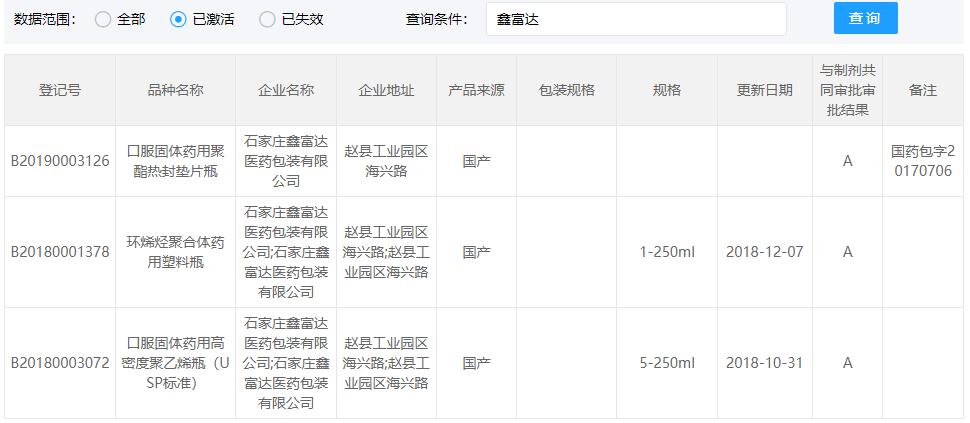
COP西林瓶CDE登记号为A状态
四、未来挑战:标准化与再生材料创新
再生COP应用:超临界CO₂清洗工艺处理再生COP,残留DNA≤0.1 ng/cm²,满足mRNA修饰支架(如抗感染人工关节涂层)的洁净要求。
智能包装系统:数字孪生技术优化COP西林瓶在自动化液氮存储系统中的堆码稳定性,使开盖破损率从0.5%降至0.02%。
从海南博鳌的先行先试政策,到北京细胞治疗产业集群的落地,COP西林瓶以无菌保障为底线、活性保护为核心、追溯安全为延伸,正成为高端植入器械不可或缺的组成部分。当手术刀划开肌肤的瞬间,那些曾在-196℃静默守护的活性成分,将在COP构建的屏障中,为生命重启修复的奇迹。
 咨询热线:400-888-1942
咨询热线:400-888-1942