ICH Q1 原料药和制剂的稳定性研究
1 简介
1.1 指导原则的目的
本指导原则概述了原料药(生物制品也称原液)和制剂的稳定性数据要求,适用于已上市产品,包括注册申报、生命周期/批准后变更相关的产品及主文件(如适用)。本指导原则统称此类申请为注册申报。ICH Q1为整合修订版,取代了ICH Q1A-F 和Q5C指导原则,并为稳定性相关原则提供了更多指导。
1.2 指导原则的适用范围
本指导原则适用于由合成技术和生物技术制备的原料药及制剂,包括:
• 化学合成原料药,包括寡聚核苷酸、多糖和多肽类(在本指导原则中统称为“化学合成实体”或“成品”)、半合成原料药以及发酵原料药。
• 采用重组DNA(rDNA)技术生产或从人体、动物或植物组织,其他天然来源(包括体液,如血浆衍生产品)或细胞培养物中分离的治疗性蛋白/多肽、多糖和蛋白聚糖。
• 由蛋白/多肽与其他分子偶联形成的制品(如抗体药物偶联物)。
• 疫苗、过敏原产品和佐剂。
• 自体和异体细胞类物质,包括体外基因修饰产品(见附录3-先进治疗药品(ATMP)的稳定性)。
• 通过遗传物质的表达(转录或翻译)介导其作用的基因治疗产品,以及用于细胞修饰的基因编辑产品(见附录3-先进治疗药品(ATMP)的稳定性)。
• 药械组合(单一实体或组合包装)的药物组成部分。
• 组合包装的溶剂/稀释剂。
• 按药品监管的天然保健品。
本指导原则适用于所有注册申报,同时根据地区法规,可适用于处方药品和非处方药品(如受监管的非处方药品)、原研药品(如新化学实体)、新剂型、简化申请(如仿制药)及生物类似药。
本指导原则适用于需要进行支持性和确证性稳定性研究的批准后变更(PAC),包括ICHQ12中讨论的情形。本指导原则虽然不直接适用于临床开发阶段的原料药和制剂,但随着药学开发中对产品和工艺的认知加深可逐渐适用。符合的开发批次的数据可用于支持注册申报及产品生命周期管理。见第15节“稳定性承诺和产品生命周期管理的考量”)。 本指导原则不适用于器械组成部分、放射性药物和全血制品。
1.3 指导原则和一般原则简介
稳定性试验的目的在于提供证据,以说明在温度、湿度、光照或搅拌等各种环境因素和物理因素的影响下,原料药或制剂的质量如何随时间变化。稳定性研究旨在建立并确认在拟定贮藏条件下及拟定的包装系统中原料药的复检期或有效期,或制剂的有效期。某些地区,有效期(Shelf life)也称为有效日期(dating period)或失效日期(expiry period)。本指导原则为其适用范围内的所有分子类型提供全面的稳定性研究指导,并就如何应用基于科学和风险的原则提出了建议。通过阐述稳定性评估的一般原则和策略,本指导原则提供了评估各稳定性相关议题的标准方法。此外,ICH Q8-Q11和Q14综述了质量源于设计的原则,因其对关键质量属性(CQAs)以及生产工艺对这些属性影响的深入理解,可将其应用于整体稳定性策略的设计。在制定稳定性研究的综合方法时,应全面考虑本指导原则。
本指导原则通过示例形式,说明了原料药和制剂的标准稳定性数据包,并为替代性及科学论证的方法提供指导,这些方法涵盖了因被评估数据的特定科学考量和特性而可能遇到的各种不同情况。注册申报的申请人可基于对原料药和制剂的科学和风险原则(如ICH Q8-Q11和 ICH Q12 的IX部分所述),利用质量风险管理原则、产品开发数据(如第2节“影响因素条件和强制降解条件下的开发研究”所述)、先验知识和建模,(如附录2-稳定性建模所述),提出替代策略。具体章节提供的示例说明了如何应用基于科学和风险的策略。除非另有说明,本指导原则中的建议同时适用于原料药和制剂。此外:
• 各章节在适用时可包含针对特定产品类型的指导(如,合成药物、生物制品、疫苗或药械组合)。
• 对于半合成、发酵和偶联产品,酌情适用合成药物和生物制品的建议。
• 本指导原则中提及的“产品”,应理解为“原料药和制剂”。
• 关于原料药和制剂稳定性研究的一般原则及数据要求的建议,适用于所有气候带的注册申报与生命周期管理。基于气候数据可推导全球任何地区的平均动力学温度,据此将全球划分为I-IV四个气候带(13、14)。四个气候带的划分基于W.Grimm(15)最初提出的理论框架,该分类依据各地区显著的全年普遍气候条件特征,后续在W.Grimm(16)的更新研究中得到完善,并被WHO技术报告(13、14)所采纳。
本指导原则涵盖全部四个气候带,确定如下原则:若稳定性信息是在更严苛的气候带贮藏条件下生成,且符合本指导原则要求,同时说明书及标签的贮藏声明符合地区要求,则可接受用于其他气候带。
• 本指导原则的建议可适用于原料药中间产品和制剂中间产品。作为生产工艺活动(如未加工的原液、颗粒混合物)组成部分贮藏的中间产品,应根据第9节“中间产品加工和保持时限的稳定性考量”进行评估。对于在生产工艺活动外进行包装和贮藏的中间产品,可依据本指导原则的适用章节(如偶联前的抗体和喷雾干燥分散体)建立保持时限,或适当设定复检期或有效期。
• 本指导原则的建议可适用于标准物质,以及含有特定辅料与佐剂的制剂,其成分的稳定性可能显著影响制剂的性能。具体指导见第12节“标准物质、新型辅料与佐剂”。组合包装的溶剂/稀释剂应遵循制剂的相关建议。
• 本指导原则对稳定性数据包的监管要求同样适用于通过连续制造(CM)工艺生产的原料药和制剂。
• 附录旨在通过以下方式补充本指导原则:提供针对强化方法的具体指导,或为具有特殊和独特稳定性考量的产品类型提供专项指导。附录1提供了简化方案设计的指导;附录2提供了稳定性建模的指导;附录3提供了先进治疗产品(ATMP)的其他考量。稳定性研究的主要类型如图1所示。 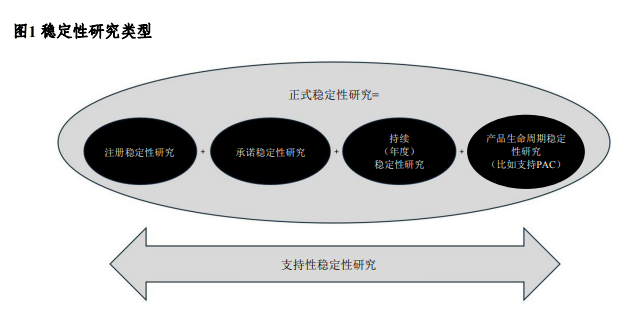
正式稳定性研究系指在加速条件、中间条件和长期条件下(如适用)开展的所有注册、承诺、持续或产品生命周期稳定性研究,以建立或确认复检期或有效期。支持性稳定性研究系指为支持产品的实际使用(包括说明书及标签声明)或复检期或有效期而开展的稳定性研究(如适用)(如光稳定性、使用期间、短期贮存条件研究和支持偏离或建模的研究)。本指导原则各章节对正式与支持性稳定性研究及其目的进行了阐述。除正式稳定性研究外,本指导原则还提供增强稳定性认知与产品理解的研究指导(见第2节“影响因素条件和强制降解条件下的开发研究”)。第2节对此类开发研究进行了介绍,因其中部分信息用于制定注册稳定性方案和验证稳定性的指示方法。
本指导原则在第3节“稳定性方案设计”至第7节“贮藏条件”讨论了方案设计策略。上述章节的建议适用于注册稳定性研究。但方案设计的原则拟适用于所有稳定性方案(如承诺、持续和产品生命周期稳定性研究,以及变更支持性研究)。
本指导原则全文引用了“代表性批次”概念以支持确定复检期或有效期。批次具有代表性的论证因原料药和制剂的类型、复杂程度和生产工艺而异,详见第4节“批次选择”。申请人在设计稳定性方案和制定产品说明书及标签信息(如贮藏声明)时,应综合考虑所有可用的稳定性知识,包括保持时限的影响、注册稳定性数据和支持性稳定性数据对长期、短期和使用期间的贮藏条件。多数情况下,稳定性方案的设计可能取决于对终产品质量的潜在影响,因此应基于质量风险管理原则。本指导原则不涉及具体的申报机制或区域要求。
2 影响因素和强制降解条件下的开发稳定性研究
产品认知有助于设计正式稳定性研究的方案。开发研究可能有助于表征贮藏期间可能发生的潜在的物理、化学和生物特性变化,以建立产品的降解特性谱和固有稳定性,确认并验证分析方法的稳定性指示能力,作为制定质量标准的依据,并评估偏离说明书及标签贮藏条件对产品的危害(见第14节“超出说明书及标签声明的偏离”)。此外,开发研究可用于帮助设计注册稳定性方案,也可应用于支持产品生命周期变更的方案(见第3节“稳定性方案设计”和第15节“稳定性承诺和产品生命周期管理的稳定性考量”)。已有产品认知的前提下,可以在加速和/或影响因素条件下(包括强制降解条件)进行研究。试验的性质应与现有认知水平、所评价原料药或制剂的类型以及所研究的质量属性相称。在规定时间内,加速条件(温度和湿度,如适用)旨在提高产品的化学降解、物理变化和/或生化反应的速率。加速条件下的数据可用于获取产品认知,支持外推、复检期或有效期的确定,并评估偏离说明书及标签贮藏条件的影响。如第3节“稳定性方案设计”至第7节“贮藏条件”所述,加速试验通常作为正式稳定性计划的一部分。为评估影响因素条件对原料药和/或制剂的影响进行的开发研究可分为两类:
1) 影响因素条件研究:条件比加速条件严苛,但非刻意诱导样品降解。
2) 强制降解研究:刻意诱导样品降解(如高温、高湿、pH值、氧化、搅拌和光照)。本节旨在介绍影响因素条件和强制降解条件下开发研究的基本原则。阐明了概念、研究设计和结果解释的考虑因素。
2.1 影响因素条件的开发研究
影响因素条件研究有助于增进产品认知,其数据可用于应对超出说明书及标签规定条件的意外偏离(见第14.1节“超出说明书及标签声明的偏离”)。影响因素条件研究可以包括高于加速条件的温度和湿度水平、热循环和冻融试验(如适用)。对于化学合成实体,上述研究可采用一批制剂进行(必要时可同时采用一批原料药进行,原料药可采用直接暴露方式或置于容器密封系统,如适用)。对于生物制品,至少应对一批制剂进行影响因素研究,但如果原料药批次能代表制剂特性,则可以提供合理性论证后使用该批原料药。
2.2 强制降解条件的开发研究
强制降解研究可用于研究潜在的降解途径;获取产品知识;了解产品的固有稳定性,并用于开发和确认分析方法具有稳定性指示特性(见ICH Q2和ICH Q14)。当可获得已鉴定的降解产物和降解途径的数据时(包括科学文献),可以利用现有产品知识。建议对单批原料药的强制降解条件进行评估,评估应包括温度、湿度(如≥75% 相对湿度(RH),如适用)、氧化和光降解的影响。应评估原料药在一定pH值范围内对水解的敏感性。此外,在某些情况下(如搅拌和加热),可能需要组合使用强制降解条件进行试验。对于制剂,建议对单批制剂开展强制降解条件,试验应包括温度、湿度(如≥75% RH,如适用)和光照的影响。对于特定类型的产品和剂型,可能需要进行额外的强制降解条件。对于生物制品,应对单批原料药进行强制降解条件的研究,或者,如果能证明制剂批次具有代表性,也可使用单批制剂。强制光降解条件可作为强制降解研究的组成部分,其目的是评估产品的整体光敏性。强制光降解研究需要采用比确证性研究更严苛的光照条件(见第8节“光稳定性”)。强制降解研究的条件和持续时间可根据产品的敏感性进行调整。开发和分析方法验证时,若发生显著性的分解,则可适当限制暴露并终止研究。同样地,对于稳定的样品,在达到适当暴露水平后可终止研究。申请人可自主设计试验方案,但应对所用的暴露水平进行论证。
2.3 结果分析与解读
在影响因素条件下(包括强制降解)进行试验时,应采用适当的检测方法,在暴露期结束时评估样品的物理、化学或生物学特性的变化(如物理状态、澄清度、颜色、降解产物、粒度、效价)(如适用)。在常规贮藏条件下不太可能发生的属性变化,但在强制降解条件和影响因素条件下可能发生(如形成降解产物)。这些信息有助于开发和验证分析方法,并可作为综合方法的一部分,用以证明整体控制策略的合理性。
这些开发研究数据可增进产品认知,帮助识别稳定性研究中需监测的稳定性指示CQA,从而协助设计稳定性方案(见第3节“稳定性方案设计”)。虽然强制降解研究不属于正式稳定性研究,但其结果是提交给监管机构的重要组成部分(如支持分析方法验证、产品表征、质量标准或包装的筛选)。若影响因素条件下的开发研究数据支持药品说明书及标签的声明,则应将其纳入注册申报资料中。
3 正式稳定性研究的方案设计
本节提供了旨在与第4节“批次选择”至第7节“贮藏条件”配合使用的指导,以建立正式稳定性 研究的方案。图2说明了申请人如何设计和制定正式稳定性研究的方案。图中的“现有稳定性 数据”是指从开发早期进行的长期和加速稳定性研究以及第2节“强力条件和强制降解条件下的开发研究”中获得的知识。如有注明,这些章节提供了关于制定注册稳定性方案的具体指导,以确定复检期/有效期(见第13节“数据评估”)。在适用的情况下,这些章节中的指导应与第15节“关于承诺与产品生命周期管理的稳定性考虑因素”(适用于承诺稳定性研究、持续稳定性研究和生命周期稳定性研究)和附录1-简化稳定性方案设计(可能适合简化研究设计)配合使用。
3.1 一般原则
当需要建立或确认复检期/有效期时,应在注册申报资料中纳入稳定性方案的摘要。稳定性方案应包含所有必要的信息,以确认原料药或制剂在其整个复检期/有效期内在推荐的贮藏条件下的稳定性。这包括对注册稳定性研究的数据和支持性数据的考虑,以告知长期贮藏、短期贮藏、偏离和使用期间条件。稳定性方案的开发、设计和执行的一般过程如图2所示。申请人负责在产品开发过程中积累知识和理解,从而确定在适当贮藏条件下具有或可能指示稳定性的CQA,并使用该信息设计方案,以支持正式稳定性研究。稳定性研究应包括对贮藏期间易发生变化且可能影响质量、安全性和有效性的属性进行检测。在产品的生命周期中,随着知识的不断获取,可以不断优化稳定性方案设计。为延长复检期/有效期而对稳定性方案进行的变更,应根据第15节“关于承诺和产品生命周期管理的稳定性考虑因素”进行确定。
来源:CDE
原文下载:![]() 【中文】Q1指导原则(草案).pdf
【中文】Q1指导原则(草案).pdf
 咨询热线:400-888-1942
咨询热线:400-888-1942




