1 2025版《中国药典》实施与口服液体制剂相关更新
2025年版《中华人民共和国药典》已于2025年3月25日正式颁布,并定于2025年10月1日起实施。根据《药品管理法》规定,《中国药典》是国家药品标准的核心组成部分,是药品研制、生产、经营、使用和监管均需遵循的法定技术标准。
强制性执行时间表:自2025年10月1日起,所有药品上市许可持有人(MAH)生产上市的药品必须符合2025版药典要求。对于在该日期前已按原标准批准上市的药品,设有6个月的过渡期,即最晚在2026年4月1日前必须符合新药典要求。而对于2025年10月1日后新提交的注册申请,其申报资料必须完全符合2025版药典的相关要求。
注册标准与药典标准的协调:药品注册标准中收录的检验项目若多于或严于药典要求,需同时执行注册标准。反之,若注册标准项目少于或指标低于药典要求,则必须执行药典规定。这要求MAH在新药典实施前后,主动开展注册标准与药典标准的对比研究,必要时按照药品上市后变更管理规定提交补充申请、备案或报告。
微生物控制要求升级:2025版药典显著提升了口服液体制剂的微生物质量控制要求,特别是将洋葱伯克霍尔德菌群列为口服液体制剂的“不可接受微生物”。这对于糖浆剂、溶液剂等水性基质的口服液体制剂提出了更严格的生产环境控制、工艺用水系统和成品检验要求。
2 儿童安全盖的核心法规与技术标准
儿童安全盖是防止儿童误服药品的关键屏障,其设计与性能直接关系到用药安全。2025年,相关法规和技术标准也迎来了重要更新。
GB/T 25163-2025国家标准更新:新版防止儿童开启包装标准《防止儿童开启包装 可重新盖紧包装的要求与试验方法》已于2025年6月30日发布,并将于2026年1月1日正式实施。该标准取代了2010年版旧规,并与国际标准ISO 8317:2015进一步接轨,提升了我国儿童安全包装要求的国际通用性与实践可行性。
“儿童难开,成人易用”的双重标准:儿童安全盖必须同时满足两项核心要求:在规定的测试条件下,85%以上的5岁以下儿童在5分钟内无法自行开启;同时,70%以上的老年人能够正常开启并使用。目前主流的压旋式设计通过需要同时完成“下压”与“旋转”的复合动作,有效利用幼儿手部协调能力尚未发育完全的特点来提供防护。
适配性与密封性:儿童安全盖需与口服液瓶(常见为28mm通用口径)良好适配,确保包装的阻湿性、密封性,防止液体泄漏或药物变质。设计时还需考虑防盗环等结构,以保障药品在流通环节中的完整性。
口服液体药用高密度聚乙烯瓶60ml压旋盖
3 口服液体制剂申报与包装关联审评的关键要点
药品注册申请与包装材料的审评已深度绑定,口服液体制剂及其儿童安全盖的申报需重点关注以下环节。关联审评审批:根据国家药监局药品审评中心(CDE)的规定,直接接触药品的包装材料(包括儿童安全盖)必须进行关联审评。包装材料的生产商需要在CDE登记平台完成登记,状态转为“A”(批准)后,方可被制剂上市许可持有人(MAH)用于上市药品的包装。申报资料中需充分体现包装材料的配方、结构、质量标准、与制剂产品的相容性研究数据以及儿童安全性能的验证报告(如扭矩测试、开启力试验等)。
2025年申报动态与剂型创新参考:2025年的药品注册申报数据显示,化药仍是主体,中药创新提速,生物制品表现亮眼。值得注意的是,剂型创新日益受到重视,例如口溶膜等新剂型的获批(如齐鲁制药的利培酮口溶膜),这反映了药品研发对患者依从性和用药安全性的追求。口服液体制剂作为传统剂型,更需通过如儿童安全盖这样的包装创新来提升其安全性和竞争力。
医保目录调整对创新剂型的关注:2025年国家医保目录调整工作已经启动,政策对“真创新”的扶持力度加大,例如对儿童用药的鼓励。虽然包装本身并非直接纳入目录的因素,但一个具有儿童安全设计、能显著降低误服风险的口服液体制剂,在体现临床价值和社会责任方面可能具有间接优势。

口服液体药用聚丙烯瓶100ml
4 行业趋势与展望
面向未来,口服液体制剂及其包装系统呈现以下发展趋势:
智能化与人性化:儿童安全盖与物联网技术结合产生智能瓶盖,可记录开启次数、提醒按时服药,提升用药依从性。同时,应用人机工程学(Ergonomics)原理优化开启方式,使其对老年人群及手部功能受限的患者更加友好。
绿色与可持续:口服液体药用复合膜、高密度聚乙烯(HDPE)瓶等可回收材质的应用日益受到重视,推动药品包装在保护药品功能与降低环境负荷之间取得平衡。
标准持续完善与监管加强:随着GB/T 25163-2025等新标准的实施,药品监管部门对包装材料,尤其是儿童安全包装的合规性检查和监管将会进一步加强。企业需持续关注药典委等官方机构发布的执行说明和问题解答,确保符合最新要求。
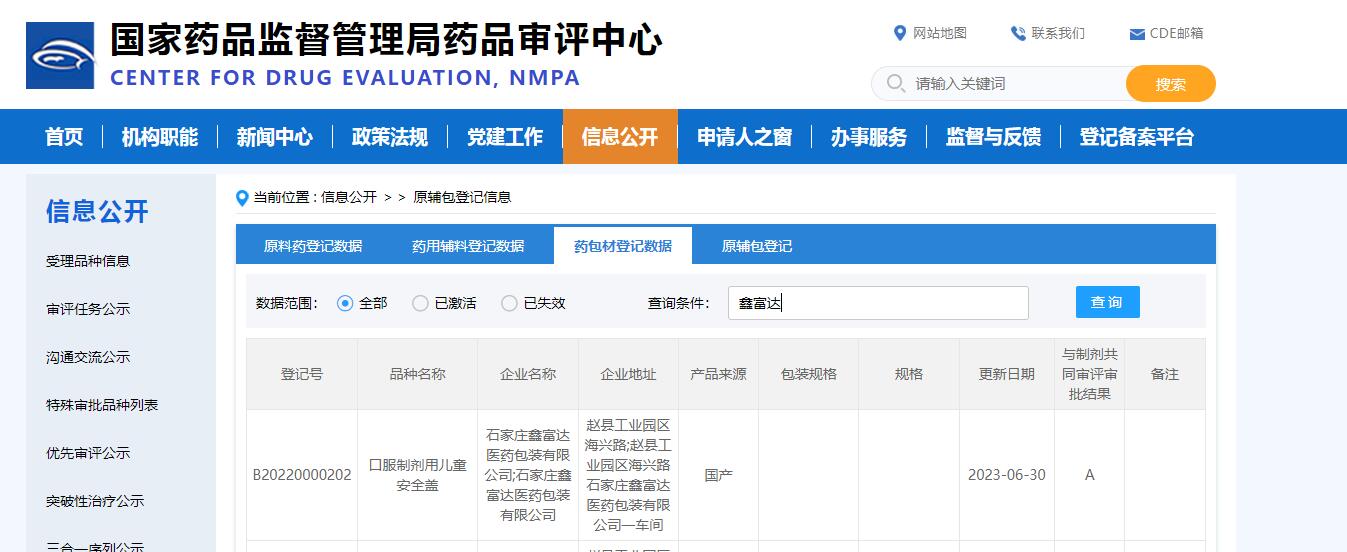
口服制剂儿童安全盖CDE登记号为A状态
2025年,对于口服液体制剂及其儿童安全盖而言,是法规标准集中更新、监管要求持续细化的一年。药品上市许可持有人和生产企业必须密切关注2025版《中国药典》的强制性实施时间表,确保药品注册标准与药典标准协调一致。在选择和使用儿童安全盖时,应严格依据GB/T 25163-2025等最新标准进行验证,确保其满足“儿童难开、成人易用”的核心要求,并通过完整的关联审评资料证明其合规性。唯有将用药安全置于首位,深刻理解并严格遵守最新政策法规和药典标准,才能在保障儿童用药安全的前提下,赢得市场认可,促进行业高质量发展。
 咨询热线:400-888-1942
咨询热线:400-888-1942






