2025年版《中国药典》将于2025年10月1日正式实施,现在已进入最后的倒计时阶段。根据国家药监局公告,对于已上市的药品设有约6个月的过渡期,企业最晚需在2026年4月1日前符合新要求。这场标准升级不仅关乎合规,更将重塑口服液体制剂行业的竞争格局。
2025年3月,国家药监局和国家卫生健康委联合颁布了2025年版《中华人民共和国药典》,并确定将于2025年10月1日起正式实施。各省药监局已陆续发布具体执行通知,如贵州、湖北和广东等地均明确要求药品上市许可持有人应对全品种进行系统梳理,对比新旧版本药典变化情况。过渡期安排为企业提供了缓冲空间。在2025年10月1日前,企业可自主选择执行原标准或新版药典标准。对于在此之前已按原标准生产的药品,可以继续上市流通。关键的时间节点是2026年4月1日,所有上市药品必须符合新药典要求,企业应制定详细的工作计划,确保在这一期限前完成所有合规工作。
微生物控制升级
2025版药典对非无菌口服液体制剂的微生物控制提出了更高要求,特别将洋葱伯克霍尔德菌群(BCC)列为重点防控对象。
BCC是一类在制药用水系统中易形成生物膜的微生物,对口服液体制剂构成显著污染风险。新药典要求企业建立专门的BCC检测程序,包括采用选择性培养基和相应的鉴别技术。药典同时引入了水分活度(aw) 概念作为评估微生物生长风险的新指标。当水分活度控制在0.6以下时,可大幅减少微生物检测要求,但需确保包装密封性。对于口服液体制剂企业,需加强纯化水系统管理,优化洁净区环境监控,并建立快速检测方法,将传统14天的检测周期缩短至3天左右。
元素杂质与残留溶剂的风险管控
2025版药典显著加强了对元素杂质和残留溶剂的管控要求。新增的通则0861《残留溶剂》和0862《元素杂质》要求制剂生产企业必须对原料药、辅料、包装材料和生产设备供应商提供的元素杂质信息进行风险评估。对于口服液体制剂企业,应特别关注以下要点:供应商管理需将元素杂质和残留溶剂的检测报告作为供应商资质审核的重要部分;根据给药途径和制剂特性确定需要重点监控的元素杂质类别;采用ICP-MS等高灵敏度仪器进行检测,确保数据准确性。药典明确要求药品生产企业应按照相关要求对元素杂质及残留溶剂进行风险评估和控制,这意味着企业需要建立更完善的供应链质量管理体系。
口服液体药用高密度聚乙烯瓶60ml压旋盖
药包材标准变更与合规策略
2025版药典对药包材标准进行了重要调整,其中玻璃包材分类重新定义为硼硅、钠钙硅等类别,并删减了耐酸碱性检测,新增了遮光性要求。
对于口服液体制剂常用的口服液体药用聚丙烯压旋盖,新规提出了更严格的要求。这类包装通过双层复合结构实现高效密封:内盖采用耐高温高压的聚丙烯(PP),确保灭菌后不变形;外盖使用高密度聚乙烯(HDPE),增强机械强度。
儿童安全机制也成为关注重点。压旋盖采用“下压+旋转”双动作开启,符合ISO 8317儿童防护标准,可有效降低误开风险。材料安全性方面,PP与HDPE均需通过生物相容性测试,确保与药品零反应。
药典实施后,企业需重新评估现有包装材料的合规性,确保符合新要求。对于仅涉及药典版本更新的标准变更,药品上市许可持有人可自行修订药品说明书和标签,无需申请备案。

口服液体药用聚丙烯瓶100ml
为顺利实现2025版药典的合规过渡,口服液体制剂企业应制定详细的实施计划:
立即启动差距分析。系统对比现有标准与2025版药典的所有差异点,重点关注微生物限度、元素杂质、包装材料等关键变化。建立差异清单并评估其对产品质量的潜在影响。
强化供应商管理。要求原料药、辅料和药包材供应商提供符合新药典要求的质量证明文件。对关键供应商进行现场审计,建立供应商变更管理沟通机制。完善检测能力与质量体系。更新质量标准和检验规程,开展人员培训,确保理解和执行新要求。建立内部审核机制,定期检查合规情况。按照药品上市后变更管理要求办理相关变更,及时更新药品说明书和标签中的执行标准项。确保所有变更在2026年4月1日前完成。
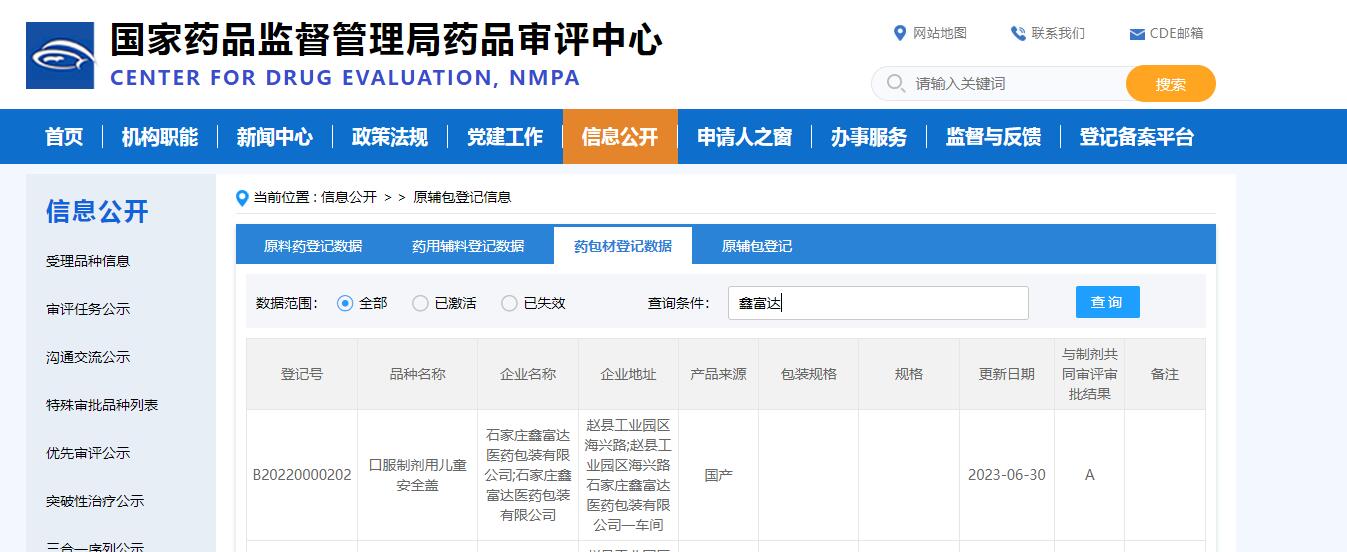
随着实施日期临近,企业应加快合规步伐,建立跨部门工作小组,每周跟踪整改进度。
只有将新药典要求深度融入企业质量管理体系,将质量控制关口前移,才能在法规升级中赢得主动,为患者提供更安全、更高质量的药品
 咨询热线:400-888-1942
咨询热线:400-888-1942






